研究内容
マウス初期発生の概略
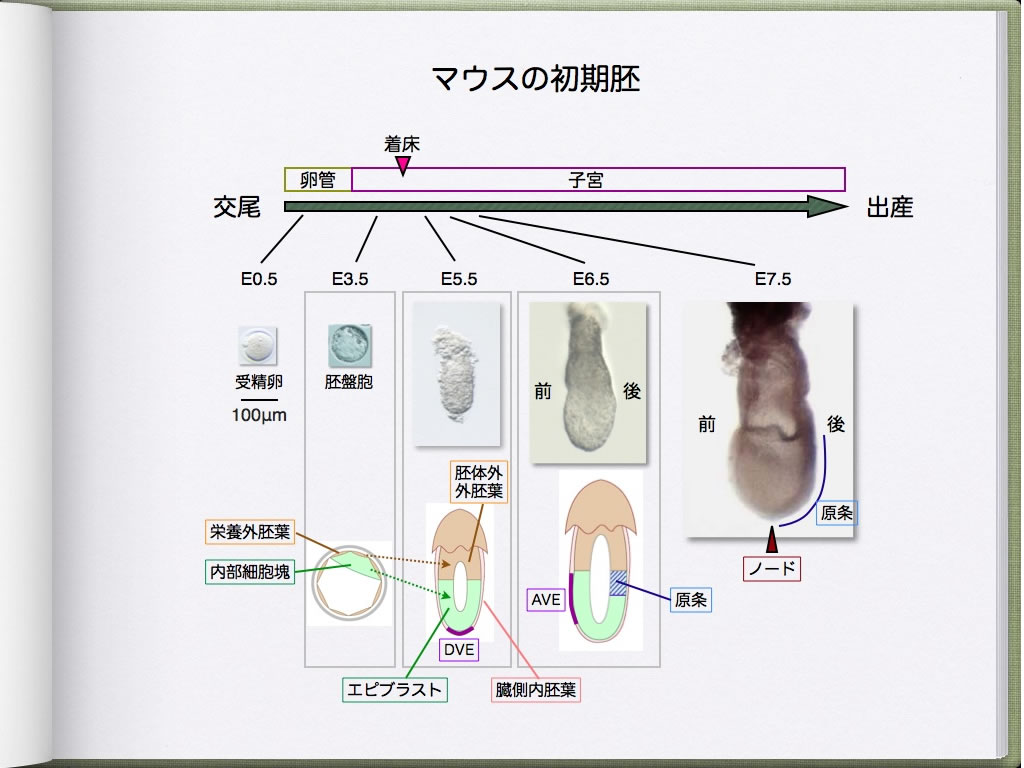
マウス受精卵は、卵割を繰り返しながら卵管を移動し子宮に辿り着き、栄養外胚葉(将来の胎盤や胎膜に寄与)と内部細胞塊(将来の体を形成)からなる胚盤胞を形成します。内部細胞塊の内腔側を原始内胚葉が覆い、内部細胞塊はエピブラストと呼ばれる組織になります。胚は着床した後、エピブラストとそれに隣接した胚体外外胚葉(栄養外胚葉由来)が内腔側へと増殖していきます。やがて両者の内部には連続した腔が生じ、周囲を臓側内胚葉が取り囲んだ筒状の卵筒胚と呼ばれる状態になります(図1)。
【 図1 】
哺乳類や鳥類の体はエピブラストから作られますが、この均一な組織から体が作られるためには前後、背腹の情報が入力される必要があります。これは、エピブラスト、胚体外外胚葉、臓側内胚葉の組織間相互作用によってなされます。例えば、胎盤と反対側の位置にある遠位臓側内胚葉の細胞群は、将来の前方(頭側)に向かって移動し前方臓側内胚葉(AVE)を形成します(図1)。AVEは、Nodal/BMP/Wntの阻害因子を分泌することで前方のエピブラストにおいてこれらのシグナルを抑制します。その結果、後方のエピブラストには原条が出現し、前方のエピブラストは神経外胚葉となり将来の脳を形成します。
原条からは上皮間葉転換によって中胚葉(初期には内胚葉も)が生じ、内胚葉とエピブラストの間を縫って移動し、卵筒胚のすべての領域に分布するようになります。原条(後の尾芽)の両側には体軸幹細胞が存在しており、神経外胚葉及び沿軸中胚葉に分化するこの幹細胞は持続的にこれらの組織を供給することで、胚には体幹部が形成され伸長します(体軸伸長)。
原条の前端にはノードと呼ばれる2層性の構造物が出現しますが、この組織は体節、神経管、耳胞のパターニングに重要な役割を果たす脊索を形成すると共に、ノード腹側層には左向きの水流が発生し、これが左右軸形成の引き金になります。水流の情報は、最終的に側板中胚葉における左右の遺伝子発現の差異に転換され(図2)、この情報に基づいて各種臓器の原基は左右非対称な形態形成を行うことになります。
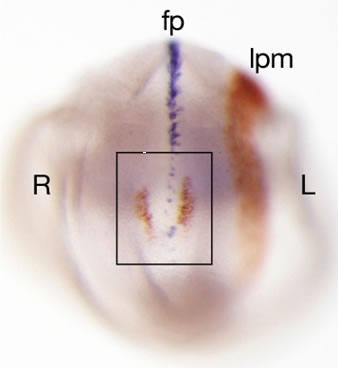
【 図2 】 E8.2胚におけるNodalとLefty1の発現
ノードの情報が側板中胚葉にもたらされ、左右非対称な遺伝子発現が確立される。Nodal(赤)、Lefty1(青)。fp, 神経底板; lpm, 側板中胚葉。胚遠位側から観察。四角はノード領域を示している。
左右軸形成
私たちの体は外見こそ左右対称ですが、内臓は顕著な左右非対称性を示します。すべての方が同じ非対称性を持つことから、この非対称性は発生学的にプログラムされたものであることが分かります。ヒトには内臓逆位等の左右に関連した先天異常が発生することがあり、多くの場合、心臓に奇形を伴います。このことは、左右を正しく決定することの必要性を示すものですが、果たしてこれを司る左右軸は発生過程でどのように形成されるのでしょうか?
私たちは、マウス初期胚(E8.2)で左右非対称に発現する遺伝子Lefty1とLefty2を見出しましたが (Meno et al, Nature 1996, Meno et al, Genes to Cells 1997)、この発見が糸口になって左右軸形成の解析が大きく進展することになりました(大阪大学濱田教授(現、理研)が、この分野を牽引しました。)。現在では、左右軸形成は以下の通りに進行すると考えられています。
ノード腹側層に存在する一次繊毛が時計回りに回転し、左向きの水流(ノード流)を形成する。この水流は、ノード辺縁のcrown cellにおける遺伝子発現に影響し、幾つかの遺伝子が左右非対称に発現する。次いで、ノード近傍の左側側板中胚葉でTGFβファミリーのNodalが発現を開始し、発現域が前後軸に沿って左側側板中胚葉全域に拡張する。Nodalシグナルは転写因子Pitx2の発現を誘導し、左側側板中胚葉の細胞系譜でPitx2発現が維持されることによって左右非対称な形態が生じる、というものです。
私たちは、内臓の左右性が逆転する(完全内臓逆位)変異マウスinvの表現型発現の機序の一端を明らかにし(Oki et al., Development 2009)、ノードcrown cellにおけるNodalとその阻害因子Cerl2発現の非対称性のバランスが、側板中胚葉におけるNodal発現を規定するというモデルを提唱しました。Nodalには、自らの発現を誘導するポジティブループの機構があります。Nodalの活性はノード左側が強く、恐らく左側側板中胚葉に先に拡散することによって、そこでNodal発現を誘導します。一度左側でNodal発現が開始すると、そのフィードバック阻害因子であるLeftyが(Meno et al., Molecular Cell 1999, Yamamoto et al., Development 2003)、右側におけるNodal発現を抑制することで一側方性のNodal発現を保証します(Nakamura et al., Developmental Cell 2006)。局所的に始まった左側のNodal発現は、ポジティブループで左側側板中胚葉全域に拡張し(Yamamoto et al., Development 2003)、前後軸に沿って心臓原基及び原始腸管の左側が「左側化」されることになります。神経底板及び左側側板中胚葉で発現するLeftyはNodalシグナルを抑制することで、Nodalが右側側板中胚葉で発現することを抑制し、これによってNodal発現域が確立されます(Meno et al., Cell 1998, Meno et al, Developmental Cell 2001)。このNodal-Leftyのシステムが破綻すると、内臓逆位や左側相同(右側が「左側化」)、右側相同(左側が「右側化」)が生じ、これに伴って複雑心奇形が発生します。
私たちは、Wnt3がノードcrown cellにおいて左右非対称に発現することを見出しました(Kitajima et al., Developmental Biology 2013)。WntシグナルはCerl2発現の抑制に関わり、Wnt3の発現域は転写因子Foxa2とRbpjの組合わせで規定されることが分かりました。RbjpはNotchシグナルを受けると、その機能は転写の抑制から活性化に転換しますが、興味深いことにNodalも同じ仕組みで発現域が規定されていました。さらに、ノードcrown cellで発現する左右軸関連遺伝子群が、Notchシグナルによってセットとして発現誘導される可能性が示唆されました。ノードは、水流を発生させるだけではなく、Nodalシグナルの制御に必要な左右軸関連遺伝子を同調して発現させ、それらの左右非対称性を制御する巧みな左右軸装置として機能していることになります。
ノードは発生過程に置ける一過的な構造ですが、その機能発現は他の発生イベントとリンクしています。例えば、原条領域のFgfシグナルは上皮間葉転換によって中胚葉を生み出すために必須の役割を担いますが、合わせて中胚葉で転写因子Tbx6の発現を誘導します。Tbx6は、ノードを取り巻く様にNotchリガンドDll1の発現を誘導し、これのシグナルがノードcrown cellに入ることによってNodal発現が誘導されます。従って、短時間のFgfシグナルの抑制でもノードのNodal発現は消失し、左側側板中胚葉のNodal発現も出現しないことになります(Oki et al., Developmental Dynamics 2010)。
糖尿病の女性が妊娠すると、子供に様々な先天異常が発生するリスクが亢進することが知られています。糖尿病による先天異常には、先天性心疾患や臓器の左右形態異常が含まれます。そこで、糖尿病マウスの胚における左右軸形成を解析したところ、左側側板中胚葉のPitx2発現が消失することが明らかになりました。このような状況は、右側相同の発生につながります。高濃度グルコースを添加した全胚培養で解析をすると、高グルコース胚のノードではNodalの活性が低下しており、これが原因となって側板中胚葉のNodal-Pitx2発現が消失したと考えられました。ノードにおける左右軸関連遺伝子群の発現は揃って抑制されており、これらを誘導するNotchシグナルの異常が示唆されました(Hachisuga et al., PNAS 2015)。
現在、左右軸形成の仕組みや関連した先天異常の解析を行っています。
前後軸形成
Rosa Beddingtonらのグループによって、マウス卵筒胚の遠位端にある遠位臓側内胚葉(DVE)の細胞集団が一側方向へ移動し、移動した側が胚の前方(頭側)になることが明らかになりました。前述の前方臓側内胚葉(AVE)からの作用によって胚には前後軸が確立されます。私たちは、DVEが移動を開始する前から、Nodalの阻害因子Lefty1とCerlがDVE領域で非対称に傾いて発現していることを見出しました。DVEはこの傾いた側へと移動し、Lefty1とCerlを異所的に局所発現させると、発現した方向へDVEが移動することから、DVE領域におけるこれらの遺伝子発現の非対称性はDVEの移動方向と移動そのものを規定していると考えられます(Yamamoto et al., Nature 2004)。AVEの作用によってエピブラストには前後の違いが生じ、後方に原条が形成されます。原条からは中胚葉と初期には内胚葉が出現し、胚全体に行き渡ることになります。原条の両側方には体軸幹細胞が存在しており、神経上皮細胞と沿軸中胚葉を継続して供給することで体幹部を生み出します。私たちは、体のすべての組織を作るエピブラストの多分化能の変遷に興味を持ち、様々なアプローチによってこれらの発生現象の解明に取り組んでいます。
エピブラスト幹細胞
エピブラスト幹細胞(EpiSC)は、マウス胚のエピブラストを単離培養することによって樹立される幹細胞です。マウスやヒトの胚盤胞から樹立されるのが胚性幹細胞(mESC, hESC)ですが、EpiSCはhESCに性質が近いことが報告されました。現在では、mESCをナイーブ型、EpiSCやhESC、ヒトiPS細胞はプライム型に分類されています。プライム型多能性幹細胞の特徴の一つとして、細胞の維持や樹立が難しいことが上げられます。私たちは、マウス初期発生の分子機構の知見を応用することで、EpiSCの培養及び樹立効率を劇的に改善する培養方法を見出しました(Sumi et al., 2013)。
内耳形成
内耳の膜迷路は複雑な形状をしていますが、その形態を生み出し構成細胞を的確に分化・配置させることは、内耳が聴覚・平行感覚を司る器官として機能するために必須です。内耳膜迷路は、発生過程で内耳プラコードと呼ばれる上皮が陥入して生じた単純な上皮の袋「耳胞」から作られます。Wntカノニカルシグナルは耳胞の「背側化」に関わることが知られていましたが、内耳発生後期における役割は不明でした。私たちは、Wntシグナルが背側領域においても外側から消失して行くことを見出し、このシグナルの抑制が半規管形成に必要であることを見出しました(Noda et al., 2012)。